Spendeninitiative 'Sternenlicht'
„Es ist wichtig, dass ihr nie einfach aufgebt. Denkt daran in die Sterne zu sehen und nicht auf eure Füße“ – Stephen Hawking
Geschichte der Spendeninitiative Sternenlicht
Nach meiner Diagnose bekam ich im Februar 2019 die Möglichkeit zur Teilnahme an der Medikamentenstudie REFALS (darüber berichte ich im Menüpunkt „Über mich“) im Studienzentrum der Universität Ulm. Natürlich habe ich das als Chance auf einen Erfolg der Studie gesehen. Aber ich wollte damit auch helfen, indem ich die Forschung mit meiner Studienteilnahme unterstützen konnte. Während der Studie habe ich immer wieder das Gespräch mit den Ärzten gesucht, da mir bekannt war, dass an der Universität Ulm aktiv an ALS geforscht wird. In einem dieser Gespräche hat mir Prof. Dr. Weishaupt die Forschungsarbeit seines Teams erklärt. In diesem Gespräch habe ich erfahren, dass Prof. Dr. Weishaupt zusammen mit Dr. David Brenner aus seinem Team und in Zusammenarbeit mit Prof. Peter Andersen von der Universität Umea in Schweden 2018 ein neues ALS Gen mit Namen KiF5a entdeckt hat. Dieses ALS Gen hat bei mir selbst die Krankheit ausgelöst. Nach dieser Entdeckung haben Prof. Dr. Weishaupt und sein Team damit begonnen, dieses neue Gen zu erforschen. Ich habe dann nach dem Gespräch die Entscheidung getroffen, diese Forschungsarbeit mit einem Spendenprojekt zu unterstützen. Denn ich sehe es als eine besondere Gelegenheit, die Forschung am Auslöser der eigenen ALS Erkrankung mit aller Kraft zu fördern und mitzuverfolgen. Zunächst habe ich beim ärztlichen Direktor Prof. Dr. Ludolph in Ulm angefragt, ob ich dieses Projekt konkret unterstützen darf und habe in diesem Zuge auch die Arbeit der Charcot Stiftung kennengelernt. Dies wurde mir bestätigt und so traf ich die Entscheidung eine Spendeninitiative mit Hilfe der Social Media Plattform Facebook zu gründen, um die Arbeit am KiF5a Gen zunächst über die Charcot Stiftung in Ulm zu unterstützen. Start der ALS Spendeninitiative Sternenlicht war der 24.08.19 mit einem emotionalen und ausführlichen Post bei Facebook.
Die Idee zum Namen Sternenlicht hatte ich, als mir im Urlaub 2019 mein Sohn einen besonders hell leuchtenden Stern am Himmel zeigte. Ein für mich besonderer, emotionaler und magischer Moment. Dieser Stern strahlte in dem Moment ein Zeichen der Hoffnung aus.
Mir und meiner Frau war bewusst, dass ich meine Erkrankung mit dieser Initiative öffentlich machte und auch aktiv den Weg in die Öffentlichkeit suchen musste. Dieser Schritt muss gut überlegt sein, denn es ist auch eine große körperliche Anstrengung für einen selbst und eine zusätzliche Belastung für den Partner. Aber dennoch war es sofort ein Herzensprojekt und meine Frau unterstützt mich bis heute zu 100 %, denn es ist uns beiden sehr wichtig. Ich hatte keine Vorstellung davon, wieviel ich mit meiner Initiative erreichen konnte und wieviel Zuspruch ich bekommen würde. Einen Betrag von 20.000 Euro hatte ich mir vorsichtig als Ziel gesetzt. Die Resonanz war enorm und viele Events und Spendenübergaben folgten (siehe auch Menüpunkt Spendenevents), wo ich auch immer die Gelegenheit nutzte, einen Vortrag über meine Krankheit und mein Projekt zu halten. Das war mir sehr wichtig um auch auf diese Krankheit aufmerksam zu machen. Das Ziel konnte bereits nach wenigen Monaten erreicht werden. Bis zum 08.03.2020 konnte ich zahlreiche Termine wahrnehmen. Die letzte gemeinsame Veranstaltung war das Konzert Klangfusion in der St. Antonius Kirche Hillmicke am 08.03.2020. Dann folgte der Lockdown aufgrund des Corona Virus und weitere für den Sommer geplante Events der Spendeninitiative fielen dem Lockdown zum Opfer und es gab leider einen deutlichen Einbruch der Spendenaktivität.
Ich danke Bruno Schmidt vom Verein Alle Lieben Schmidt e. V., der mich mit seinem eindrucksvollen und unermüdlichen Kampf gegen ALS, und für die Aufklärung und Aufmerksamkeit dieser Krankheit zu meinem Projekt inspiriert hat. Ich hoffe, dass wir zukünftig Erkrankte auch inspirieren können, damit der Kampf gegen ALS nicht aufhört.
Meine liebe Frau und mein lieber Sohn. Ihr gebt mir die Kraft, nicht aufzugeben, tragt mein Schicksal mit und ermöglicht es mir, überhaupt zu kämpfen. Dafür danke ich euch von ganzem Herzen. Ich liebe euch.
Charcot Stiftung
Die gemeinnützige Charcot Stiftung wurde 1999 unter dem Dach der Ulmer Universitätsgesellschaft von Prof. Dr. Albert Ludolph und dem seinerzeit an ALS erkrankten Dr. Carsten Hager gegründet. Ziel war es, die Vision des französischen Neurologen Jean Martin Charcot (1825-1893) voranzutreiben und die ALS Forschung der Neurologie an der Universität Ulm mit dieser Stiftung zu fördern und weiterzuentwickeln. Prof. Dr. Albert Ludolph ist ein international bekannter ALS Experte und seit vielen Jahren ärztlicher Direktor der Neurologie an der Universität Ulm und hat an deren positiver Entwicklung entscheidend mitgewirkt. Er hat in den 1990er Jahren als erster Mediziner mit der ALS Forschung in Deutschland begonnen. In den letzten zwei Jahrzehnten hat die Universität Ulm die ALS Forschung weltweit mitgestaltet und wichtige Grundlagen für die heutigen Erkenntnisse auf diesem Forschungsgebiet ermöglicht. Seit der Gründung meiner Spendeninitiative im August 2019 habe ich die ALS-Forschungsarbeit des Teams von Prof. Dr. Jochen Weishaupt an der Universität Ulm finanziell unterstützt. Prof. Dr. Jochen Weishaupt war bis Juli 2020 zuletzt 8 Jahre als Oberarzt an der Universität Ulm tätig und lehrte dort als Professur für Neurodegeneration. Ausserdem war er in Ulm Leiter der ALS Ambulanz und Leiter der molekularen ALS Forschung. Die Charcot Stiftung ermöglicht zu einem grossen Teil die ALS Forschungsarbeit in Ulm und finanziert sich ausschliesslich durch Spenden. Mit meiner Spendeninitiative konnte ich die ALS Forschung etwa ein Jahr lang mit grossem Einsatz erfolgreich unterstützen. Im Jahr 2020 bin ich mit meinem Spendenprojekt nach etwa einem Jahr dem Team von Prof. Weishaupt infolge dessen Wechsels an die Universität Mannheim gefolgt.
Sektion Neurodegenerative Erkrankungen Universitätsmedizin Mannheim
Seit 01.07.2020 hat Prof. Dr. med. Jochen Weishaupt die Leitung der neu gegründeten Sektion für Neurodegenerative Erkrankungen am Universitätsklinikum Mannheim der Universität Heidelberg übernommen. Mit einem kleinen Team der Forschungsabteilung, die alle vorher am Universitätsklinikum Ulm tätig waren, ist er an das Universitätsklinikum Mannheim gewechselt. Das Team baut damit ein neues Zentrum in Süddeutschland auf, dass sich dem gesamten Krankheitsspektrum der Neurodegenerativen Erkrankungen widmet. Das Zentrum vereint die molekularwissenschaftliche Forschung mit der spezialisierten ambulanten und stationären medizinischen Diagnostik und der Versorgung von Patienten mit neurodegenerativen Erkrankungen. ALS und andere Motoneuronerkrankungen bilden einen Schwerpunkt in der neuen Sektion. Prof. Weishaupt hat bis zu seinem Wechsel nach Mannheim, 8 Jahre lang die ALS Ambulanz, sowie die Molekulare ALS Forschung im ALS Zentrum der Universität Ulm geleitet. Mit ihm, Dr. med. David Brenner und dem weiteren Team gewinnt das Universitätsklinikum Mannheim ein erfahrenes Ärzteteam in der Betreuung von ALS-Patienten hinzu. Die Expertise zu neurodegenerativen Krankheiten wie der ALS, Parkinson oder Chorea Huntington werden damit zukünftig am Standort Mannheim vertieft. Wissenschaftlich liegt der Schwerpunkt der Arbeit von Prof. Weishaupt auf der genetischen Forschung von ALS. Dies gewinnt immer mehr an zunehmender Bedeutung im Hinblick auf die Verfügbarkeit zukünftiger genspezifischer Therapien.
Prof. Dr. Jochen Weishaupt ist ein international bekannter und geschätzter Wissenschaftler und Mediziner in der ALS-Genforschung. Dr. David Brenner aus seinem Team hat sich ebenfalls einen hervorragenden Ruf in der wissenschaftlichen Arbeit der ALS-Genforschung erarbeitet. Beide werden einen wesentlichen Teil zu dem Erfolg zukünftiger Gentherapien beitragen.
An der Universitätsmedizin Mannheim sieht der Neurologe sehr gute Voraussetzungen für die Erforschung, Entwicklung und Anwendung solcher neuartigen Therapien. „Die UMM bietet ein dynamisches Umfeld, um Grundlagenforschung und Therapie erfolgreich zusammenzuführen. Wir wollen uns als überregionale Anlaufstelle für neurodegenerative Erkrankungen etablieren“, formuliert Weishaupt die Ziele der neuen Sektion. Dazu soll in der Sektion auch eine große Biodatenbank mit Blut- und DNA-Proben von Patienten mit neurodegenerativen Erkrankungen aufgebaut werden, um die Mechanismen der Erkrankungen weiter zu erforschen und daraus Behandlungsmethoden abzuleiten.
Das Projekt zur Erforschung des neuen ALS-Gens KIF5A, das ich mit meiner Spendeninitiative Sternenlicht unterstütze
Amyotrophe Lateralsklerose (ALS) ist eine im Erwachsenenalter auftretende tödliche neurodegenerative Erkrankung. In einem beträchtlichen Teil der ALS-Fälle wird eine monogene Ursache festgestellt. Im Jahr 2018, in dem ich auch meine Diagnose ALS erhalten habe, entdeckten Prof. Jochen Weishaupt und Kollegen im Rahmen einer Studie ein neues ALS Gen namens KIF5A. KIF5A ist das Gen, dessen Mutation bei mir selbst die Krankheit ALS ausgelöst hat. Die Forscher konnten bei ALS Patienten sogenannte Spleißstellen-Mutationen in der C-terminalen Domäne des Gens KIF5A identifizieren, die zu einer fehlerhaften Funktion des entstehenden Proteinproduktes führen. Darüber hinaus fanden die o.g. Forscher eine Häufung eines bestimmten Einzelnukleotid-Polyphormismus im KIF5A-Gen bei ALS-Patienten, dessen klinische Bedeutung aber noch unklar ist.
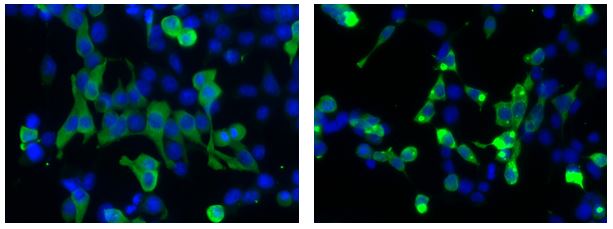
Das KIF5A-Gen ist der Bauplan für ein Protein, das am Transport von Substanzen im Axon einer Nervenzelle beteiligt ist. Die Störung intrazellulärer Transportprozesse ist auch bei mehreren anderen ALS-Formen an Krankheitsentstehung beteiligt. „Zusammenfassend fügt die (o.g.) Studie KIF5A zu einer stetig wachsenden Liste von Genen hinzu, die ALS verursachen, und erweitert das Spektrum von Mutationen in diesem Gen“, so die Aussage von Prof. Dr. Albert Ludolph von der Universität Ulm. Zudem sind weitere neurologische Erkrankungen mit unterschiedlichen Veränderungen im KIF5A-Gen assoziiert (hereditäre spastische Paraplegie, Charcot-Marie-Tooth Krankheit Typ 2, Neonatal intractable myoclonus). Die Entdeckung von Genveränderungen im KIF5A-Gen als ein Auslöser von ALS ermöglicht nun die Entwicklung neuer molekularer Therapieansätze für diese ALS-Form.
Die o.g. Studie wurde in Deutschland vor allem vom Bundesministerium für Bildung und Forschung (BMBF), von der Deutschen Forschungsgemeinschaft (ALS-Register Schwaben) von der deutschen Gesellschaft für Muskelkranke (MND-Net) sowie der Baden-Württemberg Stiftung unterstützt.
Ziel des Projekts zur Erforschung des neuen ALS-Gens KIF5A
Dr. rer. nat. Rüstem Yilmaz und Dr. med. David Brenner berichten im Folgenden über ihre Forschung zum KIF5A-Gen:
Wir haben KIF5A als neues ALS-Gen identifiziert. ALS-Mutationen in KIF5A finden sich ausschließlich in einem hot spot um Exon 27 und führen zu Spleißdefekten. Die Mutationen führen immer zu einer Leserasterverschiebung und in der Konsequenz zu einem neuen Proteinende mit der immer identischen 40-Aminosäuren-Sequenz, hier als Neopeptid bezeichnet. Die einheitliche Folge aller ALS-verursachenden KIF5A-Mutationen auf Proteinebene deutet stark auf einen toxischen Funktionsgewinn des Mutations-bedingten Neopeptids hin. Bisher fehlen jedoch experimentelle Beweise dafür. Daher werden wir die Auswirkungen der KIF5A-Mutationen auf zellulärer und biochemischer Ebene untersuchen. Dafür werden wir induzierte pluripotente Stammzellen (IPSCs) von ALS-Patienten mit heterozygoten KIF5A-Mutationen verwenden, da KIF5A ausschließlich in Neuronen gebildet wird. Wir werden unter anderem die Verteilung innerhalb der Zelle, die Proteinumsatzrate und Funktion des mutanten Proteins untersuchen. Da unsere vorläufigen Daten zeigen, dass die Mutationen die Cargo-Bindungsstelle des Proteins zumindest teilweise verändern, werden wir Interaktionspartner von KIF5A identifizieren. Die neuartigen, aufgehobenen oder in der Affinität veränderten Wechselwirkungen könnten ein Schlüssel zum Verständnis der KIF5A-ALS-Pathologie sein. Die gewonnenen Erkenntnisse werden nachfolgend in einem neu generierten Mausmodell überprüft, das später auch zur Testung spezifischer Therapien eingesetzt werden soll.
Insgesamt ist es unser Ziel, unsere Identifizierung eines neuen ALS-Gens durch funktionelle Studien weiterzuführen und die funktionellen Konsequenzen der KIF5A-Mutationen zu verstehen, um in der Folge spezifische Therapien entwickeln zu können. Dies wird auch für das Verständnis der Pathogenese der ALS im Allgemeinen von erheblicher Bedeutung sein.

„Wir stehen an der Schwelle zu einer neuen Ära in der Behandlung von neurodegenerativen Erkrankungen“, so die Aussage von Prof. Dr. Weishaupt
„Schon im Jahr 2021 werden wir voraussichtlich erstmals eine genetische Ursache der ALS wirksam behandeln können. Damit ist die grundsätzliche Machbarkeit bewiesen, die Krankheit wirksam therapieren zu können. Die Gentherapie zur Behandlung von spezifischen Formen der ALS wird damit klinische Realität. Bei Morbus Huntington gibt es ähnlich vielversprechende Therapieansätze“, skizziert Prof. Weishaupt die weitere Entwicklung in der Behandlung neurodegenerativer Erkrankungen.
Obwohl ALS, Parkinson und Chorea Huntington deutlich unterschiedliche Symptome haben, ist ihnen eine ähnliche Entstehung gemeinsam: Sie treten auf, wenn Nervenzellen vorzeitig altern und schließlich absterben. Bei ALS sind sogenannte Motoneurone betroffen, welche die Muskelbewegung steuern. Die Patienten leiden dadurch unter Lähmungen sowie Muskelschwund.
„Die Schädigung der Nervenzellen wollen wir bekämpfen, indem wir die dafür verantwortlichen Genveränderungen korrigieren“, beschreibt Weishaupt, wie zukünftige Gentherapien wirken sollen.
Das ist das zentrale Ziel der ALS-Genforschung von Prof. Weishaupt. Mein Wunsch war es von Anfang an, seine Arbeit zu unterstützen. Es ist ein Herzensprojekt für mich, die Entwicklung der Forschungsarbeit am Auslöser der eigenen Krankheit mitzuverfolgen und mit aller Kraft zu unterstützen. Ich halte den Weg dieser neuen Therapieforschung für sehr effektiv und hoffnungsvoll. Und ich glaube fest an den Erfolg, vielleicht nicht heute oder morgen, aber sicherlich in absehbarer Zukunft. Und es erfüllt mich mit Stolz und Kraft, dass ich diese Arbeit unterstützen kann. ALS hat keine Lobby, denn die statistischen Zahlen, die wohl mehr Bedeutung haben als der Mensch mit seinem Schicksal, reichen den Pharmakonzernen und dem Staat nicht, für eine ausreichende Unterstützung der ALS Forschung. Mit uns lässt sich wohl nicht genügend Geld verdienen und der Profit steht über allem. Helfen Sie mit, auf ALS weiter aufmerksam zu machen und unterstützen Sie die wichtigen Spenden an die Forschung. Die Wissenschaftler, die die hervorragende Forschung bei uns in Deutschland, mit großem Ehrgeiz und Einsatz ermöglichen, haben die nötigen Visionen. Aber es fehlt an Geld. Es muss sich endlich etwas ändern, damit nicht noch mehr Menschen dieser außergewöhnlich schweren Erkrankung ausgeliefert sind und Familien einen geliebten Menschen auf solch schwere, für alle sehr belastende Weise verlieren.
Das steckt hinter der Nervenkrankheit ALS
31.05.2021 ∙ Landesschau Baden-Württemberg ∙ SWR Baden-Württemberg
3. ALS Informationstag Bonn Vortrag Prof. Jochen Weishaupt
Prof. Dr. Jochen Weishaupt spricht im nebenstehenden ALS Podcast zusammen mit Prof. Dr. Thomas Meyer, Leiter der ALS Ambulanz an der Charité Berlin, über das Thema Genetik, und berichtet über die am häufigsten vorkommenden Gene bei der ALS und die damit verbundene aktuelle Forschung und deren Zukunftsaussichten.
Erklärung von Fachbegriffen:
Peptid – Abfolge von Aminosäuren
Neopeptid – durch die Mutation neu entstehender Teil des Proteins
IPSCs – induzierte pluripotente Stammzellen
Cargo-Bindungsstelle – Ort im Protein, an das „Fracht“ (z.B. andere Proteine) binden können
C-Terminale Domäne – Endbereich des Proteins
Einzelnukleotid-Polyphormismus – Variation eines einzelnen Basenpaares in einem komplementären DNA-Doppelstrang
Spleißstelle – Stelle, an der reguliert wird, welche RNA-Bereiche in die reife mRNA integriert werden
Prof. Dr. med. Jochen Weishaupt

Vita
| 1991-1992 | Jura-Studium an der Universität Heidelberg |
| 1992-1998 | Medizin-Studium an der Universität Heidelberg |
| 1994 | Physikum/Ärztliche Vorprüfung in Heidelberg |
| 1996 | 1. Abschnitt der Ärztlichen Prüfung in Heidelberg |
| 1996 | United States Medical Licensing Examination (USMLE), Step 1 |
| 1998 | 2. Abschnitt der Ärztlichen Prüfung in Heidelberg |
| 1999 | 3. Abschnitt der Ärztlichen Prüfung in Tübingen |
| 2000 | Abschluss der Promotionsarbeit am Zentrum für Molekulare Biologie Heidelberg (ZMBH) über Einzelzellexpression von Glutamatrezeptoren, Betreuer: Prof. Dr. Hannah Monyer, Prof. Dr. Peter H. Seeburg (Note: Summa cum laude) |
| 1998-1999 | Praktisches Jahr an der Neurologischen Universitätsklinik Tübingen (Ärztl. Direktor: Prof. Dr. med. J. Dichgans) sowie an der Harvard Medical School, Boston, und am Albert Einstein College, New York |
| 1999-2000 | Arzt im Praktikum an der Neurologischen Universitätsklinik Tübingen |
| seit 2001 | Assistenzarzt der Neurologischen Universitätsklinik Göttingen, Aufbau einer eigenen wissenschaftlichen Arbeitsgruppe, kombinierte klinische und molekularbiologisch-wissenschaftliche Ausbildung |
| 2003 | Stipendium für Forschungsfreistellung (12 Monate) der Universitätsmedizin Göttingen |
| 2005-2006 | Unterbrechung der Tätigkeit in der Neurologischen Universitätsklinik Göttingen Klinik für die Psychiatrische Weiterbildung am Psychiatrischen Landeskrankenhaus Göttingen/Rosdorf auf einer geschlossenen Aufnahmestation |
| 2009-2011 | Oberarzt der Neurologischen Universitätsklinik Göttingen |
| 2009-2011 | Leiter der ALS- und Parkinson-Ambulanz der Neurolog. Universitätsklinik Göttingen |
| 2007 | Facharzt für Neurologie |
| 2008 | Habilitation in Fach „Neurologie“ an der Universität Göttingen, Thema „Zyklin-abhängige Kinase 5 und mitochondriale Zelltodkaskaden bei neurodegenerativen Erkrankungen“ |
| 2/2011 – 10/2011 | kommissarischer Leitender Oberarzt der Neurologischen Universitätsklinik Göttingen |
| 2011 | Ruf auf W2-Professur für Neurologie (tenure track), Ltd. Oberarzt, Klinik für Neurologie, Universitätsmedizin Göttingen (abgelehnt) |
| Seit 2012 | W3-Charcot-Stiftungs-Professur für Neurodegeneration an der Universität Ulm, Oberarzt an der Neurologischen Universitätsklinik Ulm, Leiter der ALS-Spezialambulanz in Ulm |
| Seit 2012 | Koordination des Deutschen ALS-Netzwerks MND-NET (BMBF- bzw. DGM finanziert) |
| 1/2017 | Erfolgreiche Evaluation und Entfristung der W3-Professur mit Verbeamtung auf Lebenszeit |
| 8/2019 | Ruf auf W3-Professur für Neurodegeneration der Medizinischen Fakultät Mannheim (angenommen) |
| Seit 7/2020 | Leiter der Sektion Neurodegeneration, Universitätsmedizin Mannheim |
Preise
| 2015 | Heinrich Pette-Preis der Deutschen Gesellschaft für Neurologie (DGN) |
| 2015 | Felix Jerusalem-Preis der Deutschen Gesellschaft für Muskelkranke e.V. (DGM) |
| 2015 | Wissenschaftspreis der Sana AG |
Dr. med. David Brenner

David Brenner studierte von 2007 bis 2014 Humanmedizin an der Ruprecht-Karls-Universität Heidelberg. Er promovierte am Deutschen Krebsforschungszentrum Heidelberg im Labor von Prof. Dr. Ana Martin-Villalba, wo er die pathogene Rolle zirkulierender myeloischer Zellen in einem Mausmodell für die Parkinson-Krankheit untersuchte. Für seine Parkinson-Forschung wurde er mit dem „Sana Wissenschaftspreis 2016“ ausgezeichnet. 2014 begann David Brenner als Assistenzarzt seine Weiterbildung in Neurologie an der Neurologischen Universitätsklinik Ulm. Neben der stationären Tätigkeit betreute er seit 2015 ALS-Patienten in der Hochschulambulanz. Er trat der Arbeitsgruppe von Prof. Dr. Jochen Weishaupt bei, die sich der Erforschung der ALS-Genetik widmet. In den Jahren 2015 und 2016 erhielt David Brenner ein Stipendium der Medizinischen Fakultät der Universität Ulm für intramurale Forschung, um die Pathomechanismen von Mutationen im neuen ALS-Gen TBK1 mithilfe verschiedener Mausmodelle zu untersuchen. Darüber hinaus trug er zur Entdeckung der neuen ALS-Gene NEK1 und KIF5A bei und untersuchte das fäkale Mikrobiom von ALS-Patienten. Für die Entdeckung von KIF5A als ALS-Gen erhielt er 2019 den „Felix-Jerusalem-Preis 2019 für neuromuskuläre Erkrankungen“ der Deutschen Gesellschaft für Muskelkranke e.V. Für seine Forschung am ALS-Gen TBK1 wurde er 2019 zudem mit dem „NEUROWIND e.V. Nachwuchspreis für Experimentelle Neurologie“ 2018/2019 ausgezeichnet. Im Juli 2020 folgte David Brenner Prof. Dr. Jochen Weishaupt an die Uniklinik Mannheim, wo er seither in der Sektion Neurodegeneration der Neurologischen Klinik klinisch und wissenschaftlich tätig ist. Seit Januar 2021 ist David Brenner Facharzt für Neurologie.
Dr. Brenner wurde 2021 an der Universitätsklinik Mannheim zum Oberarzt ernannt. Im April 2022 wechselte Dr. Brenner wieder zurück an das Universitätsklinikum Ulm, wo er ebenfalls als Oberarzt tätig ist. Er wird dort eine eigene wissenschaftliche Gruppe aufbauen und bleibt somit glücklicherweise der Forschung neurodegenerativer Krankheiten erhalten.
Forschungsteam Sektion Neurodegeneration Universitätsklinikum Mannheim

Jonathan Uhl / Lukas Eckrich
Auf dem Foto links ist Herr Jonathan Uhl zu sehen. Er ist Medizindoktorand an der Medizinischen Fakultät Mannheim der Universität Heidelberg. Herr Uhl arbeitet in der Sektion Mannheim unter anderem in wissenschaftlicher Forschung an der neurologischen Krankheit Morbus Fahr,
Rechts neben Herrn Uhl ist Herr Lukas Eckrich zu sehen Er arbeitet als Technischer Assistent in der Sektion Neurodegeneration.

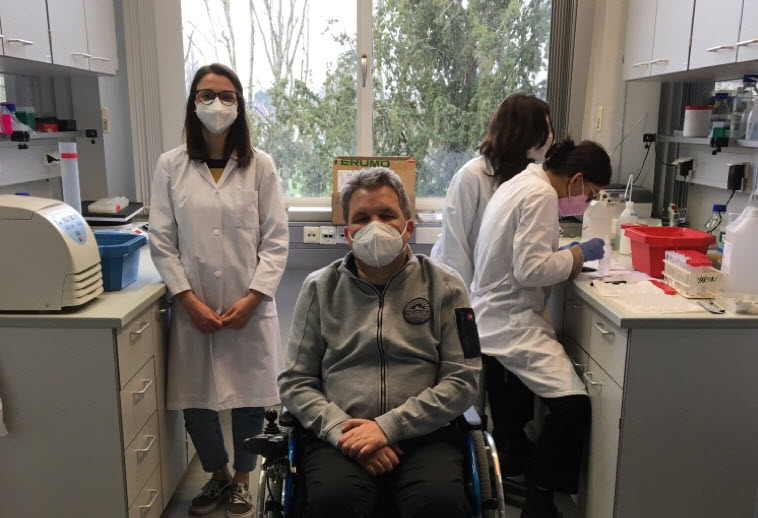
Dr. rer. nat. Rosanna Parlato / Yasmin Douahem
Frau Dr. rer. nat. Rosanna Parlato, auf dem Foto 3. Person von rechts ist eine sehr erfahrene Wissenschaftlerin und zugleich Ansprechpartnerin für alle Bereiche und Projekte der Forschung innerhalb der Sektion Neurodegeneration Mannheim.
Sie arbeitet an der Erforschung des ALS-Gens TBK1, dass von Prof. Weishaupt und seinem Team vor einigen Jahren entdeckt wurde. Ebenso ist sie an der Erforschung der Huntington Krankheit tätig.
Frau Yasmin Douahem, auf dem Foto 2. von rechts, ist Medizindoktorandin an der Medizinischen Fakultät Mannheim der Unversität Heidelberg. Sie arbeitet zusammen mit Frau Dr. Parlato an den Projekten TBK1 und Huntington.
Dr. rer. nat. Rüstem Yilmaz
Dr. rer. nat. Rüstem Yilmaz arbeitet als Postdoc (Wissenschaftler) in der ALS Forschung.. Er ist zentraler, bedeutender und leitender Mitarbeiter in der Forschungsarbeit am KIF5A Gen. Diese Arbeit ist das zentrale Projekt, dass ich mit meiner Initiative unterstütze.
Dr. Yilmaz arbeitet vor allem an biochemischen Veränderungen beim KIF5A in ALS Mutationen und damit verbundenen kultivierten Neuronen.
Desweiteren ist er als Supervision von Herrn Pfeiffer tätig.
Dr. Yilmaz ist ein Wissenschaftler mit mehrjähriger Erfahrung. Er arbeitet bereits seit einigen Jahren im Team von Prof. Weishaupt in der ALS Forschung und auch speziell am KIF5A Gen.
Julian Pfeiffer
Herr Julian Pfeiffer ist Medizindoktorand an der Medizinischen Fakultät Mannheim der Universität Heidelberg. Er arbeitet intensiv und erfolgreich mit Dr. Yilmaz zusammen am KIF5A Gen und kultivierten Nervenzellen., die aus dem Gen entstehen.
Herr Pfeiffer ist durch seine Arbeit am KIF5A Gen ebenfalls ein bedeutender Mitarbeiter für das Projekt Sternenlicht.
Isabel Loss
Frau Isabel Loss ist biologische Doktorandin an der Medizinischen Fakultät Mannheim der Universität Heidelberg. Neben Dr. Yilmaz und Herrn Pfeiffer ist Frau Loss eine ebenfalls bedeutende und zentrale Mitarbeiterin in der KIF5A Forschung.
Frau Loss stellt aus meinen Blutzellen jeweils Stammzellen her. Aus den Stammzellen werden dann wiederum Nervenzellen hergestellt, an denen sie dann in Zusammenarbeit mit dem Hector Institut Mannheim forscht. Die KIF5A Stammzellen sind auch Thema ihrer Doktorarbeit. Im Laufe des Jahres 2022 ist der Einsatz einer neuen Behandlungsmethode gegen die KIF5A Mutation in meinen Zellen geplant.
Frau Loss arbeitet mit Unterstützung von Dr. Yilmaz und Herrn Pfeiffer an einer Methode, die Menge an giftigem KIF5A Protein in den Nervenzellen zu reduzieren.

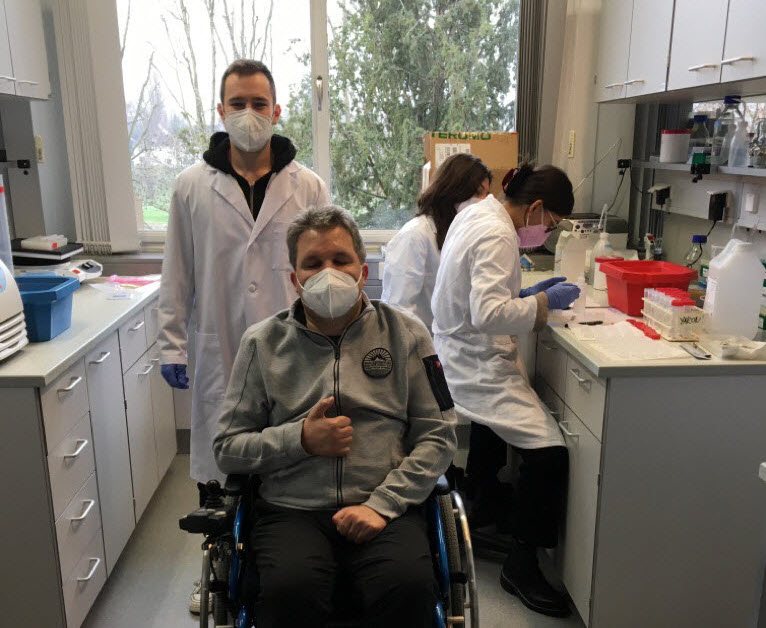
Jasper Hesebeck-Brinkman
Herr Hesebeck-Brinkmann arbeitet noch bis Februar 2023 im Labor an der ALS Forschung mit und wird ab März 2023 zunächst im stationären Bereich, das Ärzteteam der Sektion Neurodegeneration als Assistenzarzt im klinischen Bereich verstärken.
Dr. Ivan Valkadinov
Dr. Ivan Valkadinov gehört bereits seit zwei Jahren zum Team Neurodegeneration und ist als Assistenzarzt für den klinischen Bereich zuständig.
Seit Oktober 2022 ist er im Forschungsfrei als Unterstützung im Forschungsteam tätig.
Er beschäftigt sich dort hauptsächlich mit genetischen Modellen der ALS.
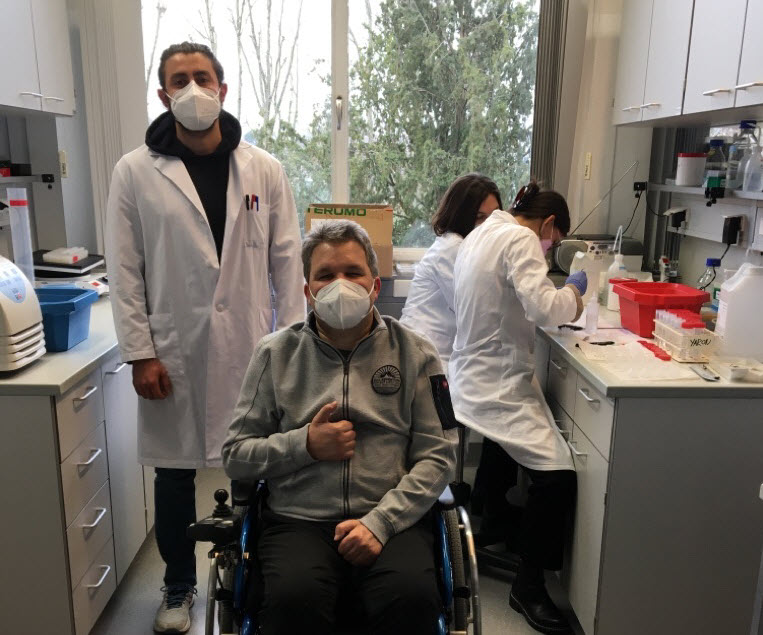
Dr. Julian Conrad
Als neues Mitglied im Ärzteteam möchte ich hier Oberarzt Dr. med.Julian Conrad vorstellen. Kennengelernt habe ich Dr. Conrad ebenso wie Dr. Valkadinov bei meinem Besuch am 11.10.22 in Mannheim.
Auf dem Bild links neben mir ist Dr. med. Julian Conrad zu sehen. Dr. Conrad ist der neue Oberarzt der Sektion Neurodegeneration in Mannheim. Er ist ein erfahrener Facharzt für alle Neurodegenerative Erkrankungen, vor allem ALS und Parkinson.
Dr. Conrad war vorher in der Neurologie am Klinikum Großhadern der Universität München tätig
ALS
Spendeninitiative
Sternenlicht
Thorsten Voß
Könisgsberger Straße 29
57482 Wenden – Rothemühle




